隨著環境保護事業的迅速發展,人們對濕地功能也有了廣泛的認識。濕地作為“地球之腎”,擔負著對地球自然水體的凈化和處理功能。由于城市中天然濕地的逐漸減少和消亡,因此,人工濕地以其獨到的優越性受到了越來越多的關注和發展。
近年來,寧夏人工濕地的數量和面積不斷增加,如沙湖、閱海、鳴翠湖等景觀湖泊已成為重要的風景區。同時,寧夏境內的人工濕地也存在富營養化的趨勢,人工種植蘆葦、香蒲等水生植物,既能滿足濕地造景的需要,也能降低水體中的氮磷等營養鹽的含量,可謂一舉兩得。蘆葦、香蒲是寧夏銀川平原本土植物,具有短期成型及快速成景等優點。
蘆葦是濕地常見的挺水植物,為被子植物門單子葉植物綱禾本科水生植物。蘆葦多生于低濕地或淺水中,生長在灌溉溝渠旁、河堤沼澤地、河溪邊等多水地區。蘆葦植株高大,地下有發達的匍匐根狀莖,繁殖力強,生物量大,具有很強的環境適應能力,可以適應比較惡劣的環境條件。蘆葦對多種污染物抗性強,具有很好的水質凈化作用,在濕地生態系統中發揮著重要作用,因而成為濕地種植的水生植物的優先選擇。自然生長的蘆葦,以種子和根狀莖繁殖。在造景綠化過程中,由于水生植物恢復生長要求較高,受環境制約因素較多,所有大多采用人工采挖及移栽的辦法,目前,尚缺乏簡便易行成本低廉的快速繁殖的方法。因此,探索蘆葦的組培育苗方法是非常有必要的。組培技術的應用很廣泛,很多種植物都實現了利用組培育苗的方法進行快繁。葉保君等在花葉蘆竹組培試驗中取材為秋季植物莖稈的側芽為外植體,取材受季節和材料的限制,在春季不能進行有效組培快繁。本試驗就莖段作為外植體,取材方便,不受季節限制,篩選合適的培養基和激素配比濃度使莖段在節處產生側芽,進而生出新根形成組培苗,建立和優化蘆葦的組培快繁技術體系,以期為蘆葦的組培快繁生產提供操作流程和數據參考,為批量生產蘆葦組培苗并應用于人工濕地建設和園林水景建設提供理論依據。
1 材料與方法
1.1 材料
取蘆葦葉片、節間、節作為不同的外植體;選取1/2MS、MS、N6培養基作為培養基質。植物生長激素為6-BA、NAA、IBA。
1.2 方法
1.2.1 培養基的篩選 取夏季蘆葦葉片,用清水沖洗干凈,剪切成大小一致的小片,按如下方法消毒:(1)用無菌水洗3次;(2)用70%乙醇消毒30 s,無菌水沖洗3次;(3)0.1%氯化汞消毒5 min,無菌水沖洗5次[9],沖洗過的外植體放在已滅菌的濾紙上吸干水分,然后分別接種到1/2MS、MS、N6 3種培養基上,控制環境條件,培養溫度(25±2)℃,光照時間為12 h/d(下同),光強1 500~2 000 lx,光照12 h/d。在此條件下培養,觀察其生長狀況。
1.2.2 外植體的篩選 取蘆葦的葉片、帶節的莖段分別作為不同的外植體,按如下方法消毒:(1)用無菌水洗3次;(2)用70%乙醇消毒30 s,無菌水沖洗3次;(3)0.1%氯化汞消毒5 min,無菌水沖洗5次,沖洗過的外植體放在已滅菌的濾紙上吸干水分,分別接種到1/2MS培養基上,控制環境條件,培養溫度(25±2)℃,光強1 500~2 000 lx,光照12 h/d。在此條件下培養,觀察其生長狀況。
1.2.3 外植體消毒方法的篩選 取夏季蘆葦帶節的莖段,用清水沖洗干凈,剪切成大小一致小節,按如下方法消毒:(1)用無菌水洗3次,用70%乙醇消毒30 s,無菌水沖洗3次,再用0.1%氯化汞消毒5 min,無菌水沖洗5次。(2)用無菌水洗3次,用70%乙醇消毒40 s,無菌水沖洗3次,再用0.1%氯化汞消毒7 min,無菌水沖洗5次。(3)用無菌水洗3次,用70%乙醇消毒20 s,無菌水沖洗3次,再用0.1%氯化汞消毒3 min,無菌水沖洗5次。
沖洗過的外植體放在已滅菌的濾紙上吸干水分。以上3組處理材料分別接種在1/2MS培養基上,控制環境條件,培養溫度(25±2)℃,光強1 500~2 000 lx,光照12 h/d。在此條件下培養,觀察其生長狀況。
1.2.4 不同濃度激素配比對蘆葦側芽分化的影響 取蘆葦莖稈,在節間處剪斷,剪成長約1.5 cm的小段。把節段放入燒杯中用自來水沖洗數次,再倒入70%乙醇的燒杯中洗30 s,無菌水沖洗3次,再放入0.1%氯化汞中洗5min,無菌水沖洗5次。把已經沖洗好的節段放在已經滅菌的濾紙上吸干水分,備用。把準備好的材料接種在含有不同濃度激素的上述培養基上。控制環境條件,培養溫度(25±2)℃,光強1 500~2 000 lx,光照12 h/d。在此條件下培養,觀察節段的側芽生長情況。
1.2.5 不同濃度激素配比對蘆葦生根的影響 取蘆葦莖稈,在節間處剪斷,剪成長約1.5 cm的小段。把節段放入燒杯中用自來水沖洗數次,再倒入70%乙醇的燒杯中洗30 s,無菌水沖洗3次,再放入0.1%氯化汞中洗5 min,無菌水沖洗5次。把已經沖洗好的節段放在已經滅菌的濾紙上吸干水分,備用。把準備好的材料接種在含有不同濃度激素的上述培養基上。控制環境條件,培養溫度(25±2)℃,光強1 500~2 000 lx,光照12 h/d。在此條件下培養,觀察外植體的生根情況。
2 結果與分析
2.1 不同培養基對外植體生長的影響
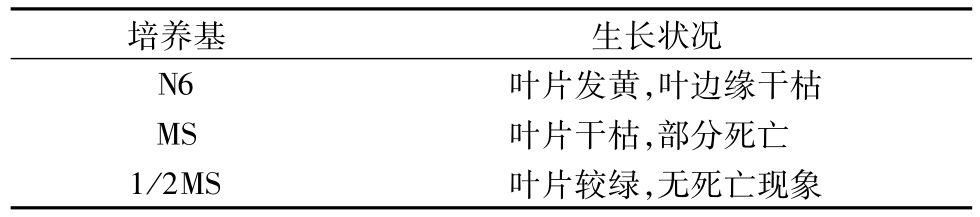
以蘆葦葉片為材料,在相同培養條件下3種培養基中的的生長情況見表1。結果表明,1/2MS培養基中的生長情況比其他2種培養基的培養效果好,葉片相對較綠,短期內無外植體死亡現象。N6、MS中外植體均出現葉片干枯發黃,可能原因是其培養基中大量元素的濃度過大,使植物細胞的外壓過大,植物細胞失水死亡。表明1/2MS培養基中的離子濃度更適合蘆葦外植體生長。
表1 不同培養基上蘆葦外植體生長狀況
2.2 外植體的篩選
在節間、帶節的莖段、葉片3種不同的外植體中,只有帶節的莖段可以長出側芽,節間、葉片均無分化現象,沒有愈傷組織產生,原因可能是蘆葦節中存在居間分生組織,有利于形成愈傷組織,有利于側芽分化。
2.3 不同消毒方法對外植體生長的影響
從表2可以看出,70%乙醇30 s、0.1%氯化汞5min的消毒效果佳。氯化汞本身是劇毒品,盡管使用時稀釋到很低的濃度,對于植物細胞來說還是有很大傷害,所以其清洗時間不宜過久,但時間過短又達不到消毒的效果。每次氯化汞消毒完畢,要用無菌水沖洗5次左右,保證外植體清洗干凈。
表2 不同消毒方法對蘆葦外植體生長的影響

2.4 不同濃度激素配比對蘆葦側芽分化的影響
把蘆葦莖段材料接種在含有不同濃度激素的培養基上進行培養,培養期間每天進行觀察,以培養25 d觀察結果進行分析。
從表3可以看出,NAA濃度在0.3~0.5 mg/L之間,6-BA濃度在0.6~1.0 mg/L都可以長出側芽,效果好的是NAA 0.4 mg/L+6-BA 0.6~0.8 mg/L的濃度配比。2.5 不同濃度激素配比對蘆葦生根的影響
表3 不同激素濃度配比對蘆葦側芽生長的影響
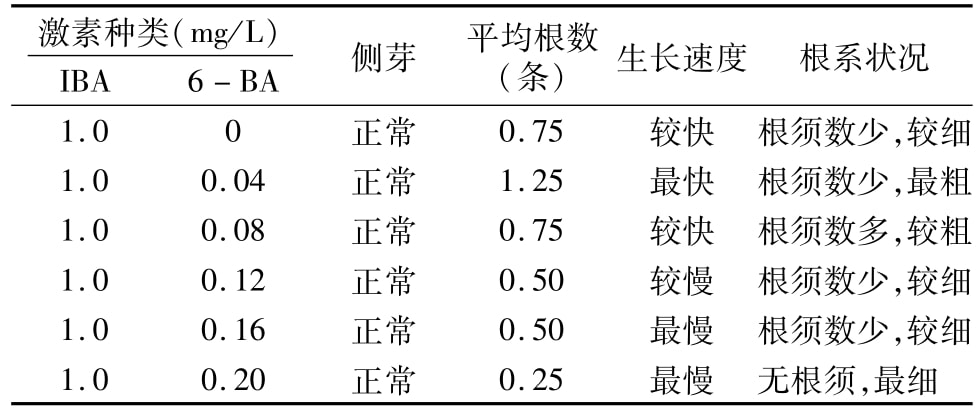
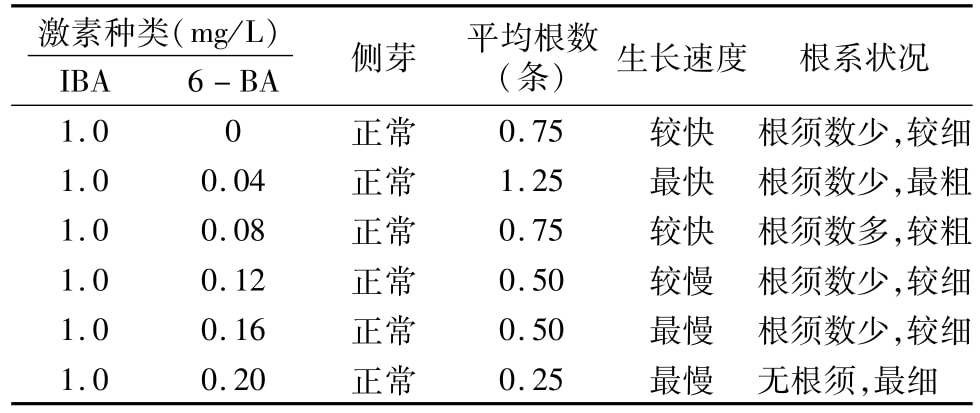
在IBA濃度為1.0 mg/L、6-BA濃度為0~0.20 mg/L時均有生根現象發生,生根狀況佳的濃度配比是IBA 1.0 mg/L、6-BA 0.04 mg/L(表4)。在此生根條件下,所有節段均可產生側芽,并可在側芽生出15 d左右出現生根現象,即在這個濃度配比下,外植體均是先分化長出側芽,然后在側芽上長出新根。
表4 不同激素濃度配比對蘆葦生根的影響
2.6 培養基的簡化
為了降低成本以利于今后生產推廣,本研究在原培養基的基礎上,進行簡化試驗,將配制培養基的蒸餾水改用自來水,培養基中的蔗糖成分均可改為白砂糖,但需適當加量,試驗結果無明顯差異。高壓鍋對試驗器具的滅菌時間可由原來的40 min減少至20 min,對試驗結果無影響。
2.7 蘆葦組培苗的移栽
當組培苗長到6~7 cm的時候,根系能主動吸收環境中的營養和水分,可以進行移栽。把組培苗移栽到含有腐殖質和沙土的花盆里,注意保濕保溫和光照。
3 討論與結論
從本試驗結果來看,對于外植體的選擇,用帶節的莖段作外植體,有利于長出側芽的激素配比為NAA 0.4 mg/L+6-BA 0.6~0.8 mg/L。
有關蘆葦快速繁殖技術的研究中還沒有組織培養方面的報道,本試驗對蘆葦的快繁技術進行了研究。促進側芽分化的培養基和促進生根的培養基在激素配比上差異較大,在側芽分化后,轉移到生根培養基的過程中,污染嚴重且過程不易操作,試驗結果表明,在IBA濃度為1.0 mg/L、6-BA的濃度為0~0.20 mg/L時,外植體均有生根現象發生,生根狀況佳的是濃度配比為IBA 1.0 mg/L、6-BA 0.04 mg/L。避免了在側芽長出后更換培養基的步驟,使過程更為簡單容易操作。當試管苗長到6~7 cm的時候,根系就能主動吸收外界環境中的營養和水分,這時可以進行移栽,把試管苗移栽到含有腐殖質和沙土的花盆里,注意保濕保溫和光照,試管苗生長狀況良好。移栽后煉苗和移栽大田的管理過程還需進一步試驗研究。
版權聲明:文章來源于http://m.58155x.com/news/detail/id/434.html,轉載請注明出處!
上一個:金線蓮組培快繁技術研究
下一個:鐵皮石斛組培體系的建立